The long-standing mystery on the functional roles of the N-terminal region of protein N-myristoyltransferase, an ideal target for antifungal drugs, was recently decoded, thanks to the three-year joint efforts of researchers from the CAS Key Laboratory of Molecular Biology and their US colleagues at the DuPont Stine Haskell Research Center.
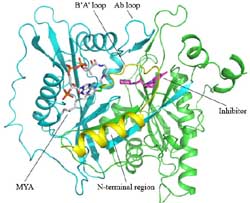
The protein N-myristoylation catalyzed by enzyme myristoyl-CoA:protein N-myristoyltransferase (NMT) plays an important role in a variety of key cellular processes. Myristoyl-CoA (MYA) is initially bound to NMT, which induces a conformational change and forms a binding site for the protein substrate. Then CoA is released prior to dissociation of the myristoylated peptide.
Genetic and biological data show that NMT is essential to the growth and survival of a number of yeast strains and parasites. Therefore, it becomes an attractive therapeutic target for antifungal drugs, as well as a potential target for antiviral, antiparasitic, and even antineoplastic chemotherapy.
Despite the obvious significance of understanding the structural basis of the recognition and binding of substrates with the enzyme, previous structural studies had all failed to identify the N-terminal region of NMT of two species, as it was either removed to facilitate the studies or found disordered in the structures.
The research groups headed by Prof. Jianping DING from the Shanghai-based CAS Institutes for Biological Sciences and Dr. Steven Gutteridge from the US side, respectively, closely examined three crystal structures of full-length Saccharomyces cerevisiae NMT (ScNMT): in binary complex with MYA alone and in two ternary complexes involving MYA and two different non-peptide inhibitors. With the help of modern structural biology and biological chemistry, researchers were able to reveal the functional roles of the N-terminal region of ScNMT. According to their paper published online by the Journal of Biological Chemistry, in all three structures, the majority of the N-terminal region forms a well-defined structure with an α-helix and a loop (B'A' loop) at the vicinity of the peptide substrate-binding site. The Ab loop, which was previously suggested to be involved in the substrate recognition, adopts an open conformation, whereas the B'A' loop of the N-terminal region covers the top of the substrate-binding site and occupies the position of the Ab loop when it is in the closed conformation. It is demonstrated that the N-terminal region is crucial for binding of both MYA and the peptide substrate, but not for the subsequent catalytic reaction.
In analyzing the ternary complexes, experts found that the two inhibitors occupy the peptide substrate-binding site and interact with the protein through primarily hydrophobic contacts. The inhibitor-enzyme interaction analysis provided valuable information for improvement of antifungal inhibitors targeting NMT. Through chemical modification and conformational reconstruction, scientists will hopefully enhance the therapeutic effects of relevant drugs in the near future.





