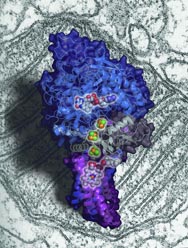
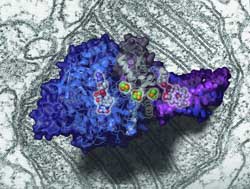
New insights into the mechanism of mitochondria, the subcellular structures which generate energy for living cells, have been obtained by scientists at the CAS Institute of Biophysics (IBP) and Tsinghua University. They have determined, for the first time in the world, the crystal structure of Complex II (also known as succinate:ubiquinone oxidoreductase), one of the four respiratory membrane protein complexes located in the mitochondrion.
Mitochondria, as cellular organelles, are the "energy factory" of the cell and are mainly responsible for cell aerobic respiration. They realize energy transformation through the oxidation-phosphorylation process and provide most of the energy for cell activity. The oxidation process in mitochondria is carried out by four respiratory membrane protein complexes inside the mitochondrial inner membrane (Complex I, II, III and IV).
Since the 1990s, mapping the three-dimensional structures of these four membrane protein complexes has been a major research focus in biology. For many years, scientists have made great efforts, trying to make advances in this area. Until recently, however, only the crystal structures of Complex III and IV had been solved.
Three years ago, a joint team led by Prof. Zihe Rao, IBP director and Vice-dean of the Medical School, Tsinghua University, began their efforts to solve the three-dimensional structure of the Complex II using new methods.
They opted to extract and purify this membrane protein complex from porcine heart and finally completed the determination of its three-dimensional structure, which is comprised of four different proteins. Their work was published in the July 1 issue of
Cell.
This work is important because it provides a
bona fide Imodel for study of the mitochondrial respiratory system, increasing scientists' understanding of one of the most fundamental processes of biological systems, says Prof. Rao, who came back to China in 1996 after spending eight years in the Laboratory of Molecular Biophysics, Oxford University in UK. It will also facilitate the development of therapies to treat human mitochondrial diseases related to mutations in this complex, he notes.
The structure determination of membrane proteins is a very challenging and frequently unrewarding task. Complex II is one of the few membrane proteins whose structures have been solved in the world to date, and is the second such achievement by Chinese scientists. In 2004, IBP researchers succeeded in determining the crystal structure of the major light-harvesting complex of photosystem II (LHC-II)
With the determination of the Complex II structure, scientists now have more than half of the mitochondrial respiratory membranes filled in. What remains is the Complex I protein, and that has become a new target for Prof. Rao and his colleagues in coming years.






