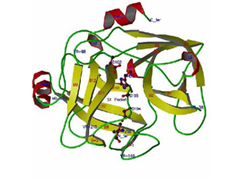
The Helices are colored in red, ß-sheets in yellow and coils in green. The active sites (carbons, cyan) are shown in ball-and-stick model.
As a result of five-year-long arduous work, CAS scientists recently succeeded in determining the structure of lumbrokinase (earthworm fibrinolytic enzyme), shedding light on the understanding of this drug at the molecular level and laying a foundation for its structure-based drug design.
Cardiac and cerebral vascular diseases are recognized as one of the three most murderous sicknesses now rampant in human population. Eight years ago, Chinese scientists succeeded in extracting lumbrokinase from earthworm and developing it into a novel thrombolytic drug of the 2nd National Category. Since then, many scientists have devoted themselves to investigating its thrombolytic mechanism.
The function of a protein is determined by its structure. Hence, studies on protein structures have become a research focus and attracted substantial investments from many multinational corporations and developed countries. Renowned for their outstanding achievements in determining the 3D structure of porcine insulin, Chinese scientists now aim at a new target and spare no efforts in determining as many as possible protein structures intimately tied to human health so as to provide a new basis for new drug development.
Earthworm used to be called an "earth-dragon" in the traditional Chinese medicine. As a novel biochemical medicine, lumbrokinase from earthworm manifests notable thrombolytic effect.
What is the molecular basis of thromobolysis of lumbrokinase? Under the joint support of the National Natural Sciences Foundation of China and the National Priority Basic Research Program (or 973 Program), a research group headed by Prof. Chang Wenrui at the National Laboratory of Biomacromolecules, Institute of Biophysics, CAS has dedicated to crack the nut since 1997. Prof. Chang 's group has isolated seven fibrinolytic components from lumbrokinase crude powder from earthworm
Eisenia fetida, one of which, named EFE-a, can not only directly degrades fibrin, but also indirectly degrade fibrin by activating plasminogen. The group has filed for an invention patent for the procedure of the purification and preparation of them.
By X-ray diffraction methods, the group has determined the 3D structure of one component (EFE-a), that is, the coordinates of all its several thousand non-hydrogen atoms. The coordinates and related data have been deposited to the Protein Data Bank (PDB) to be shared with scientists all over the world. The research results have been published in an international journal,
Journal of Molecular Biology. All these have provided a structural basis for the modification of lumbrokinase. Besides, the group has determined another component of lumbrokinase recently and it is now engaged in the structural determination of other components of the earthworm extract.







